Futur traitement pour la maladie de Parkinson : les cellules souches
Contexte
La maladie de Parkinson est la seconde atteinte neurodégénérative la plus répandue après la maladie d’Alzheimer, c’est également la seconde atteinte d’origine neurologique responsable d’handicap moteur, derrière l’AVC. Cette pathologie touche environ 160.000 personnes en France, on compte 25.000 nouveaux cas diagnostiqués par an.
Au niveau physiopathologique, cette maladie se caractérise par une dégénérescence neuronale progressive, en particulier au niveau des neurones dopaminergiques de la voie nigro-striée. Ces neurones relient la substance noire au striatum (d’où son nom, noire = nigro ; striatum = striée) et permettent de réguler l’activité des noyaux gris centraux. Ces derniers, aussi appelés ganglions de la base, jouent un rôle majeur dans l’initiation et l’exécution des mouvements, notamment par leur relation avec le thalamus et le cortex moteur. La perte des neurones dopaminergiques va entraîner une dérégulation au niveau de ces noyaux gris centraux et, à plus grande échelle, une atteinte des boucles de régulation motrices. Cependant les mécanismes à l’origine des symptômes ne sont pas encore totalement élucidés. On estime que ces symptômes apparaissent après une dégradation d’environ 80% des neurones sécrétant de la dopamine.
Les traitements développés consistent en un apport de dopamine externe (levodopa), de molécule mimant l’action de la dopamine (agoniste dopaminergique), ou à une modulation de l’activité électrique cérébrale (stimulation cérébrale).
Ces thérapies sont en perpétuelle évolution, les récentes avancées nous ont permis de mettre en lumière de nouvelles cibles thérapeutiques et d’imaginer de nouvelles prises en charge.
La greffe de cellules dopaminergiques issues de cellules souches induites (iPSc) a déjà démontré des résultats prometteurs, la première étude clinique sur l’Homme est actuellement en cours…
Principe de la thérapie cellulaire pour la maladie de Parkinson
Cette technique consiste à remplacer les neurones dopaminergiques détruits par de nouvelles cellules produites en culture (in vitro). La greffe cellulaire dans le cadre de la maladie de Parkinson n’est pas une méthode nouvelle, elle a déjà été étudiée à travers plusieurs études cliniques et pré-cliniques. Les cellules dopaminergiques, constituant le greffon cellulaire, peuvent être obtenues à partir de différentes populations de cellules souches, comme les cellules souches embryonnaires (ESc) ou les cellules souches pluripotentes induites (iPSc).
L’équipe de Takahashi a lancé en 2018 la première étude sur l’Homme basée sur la greffe de cellules souches issues d’IPSc dans le cadre de la maladie de Parkinson.
Le but de cette première étude sera d’estimer l’efficacité, mais avant tout la sécurité de cette approche en thérapie cellulaire.
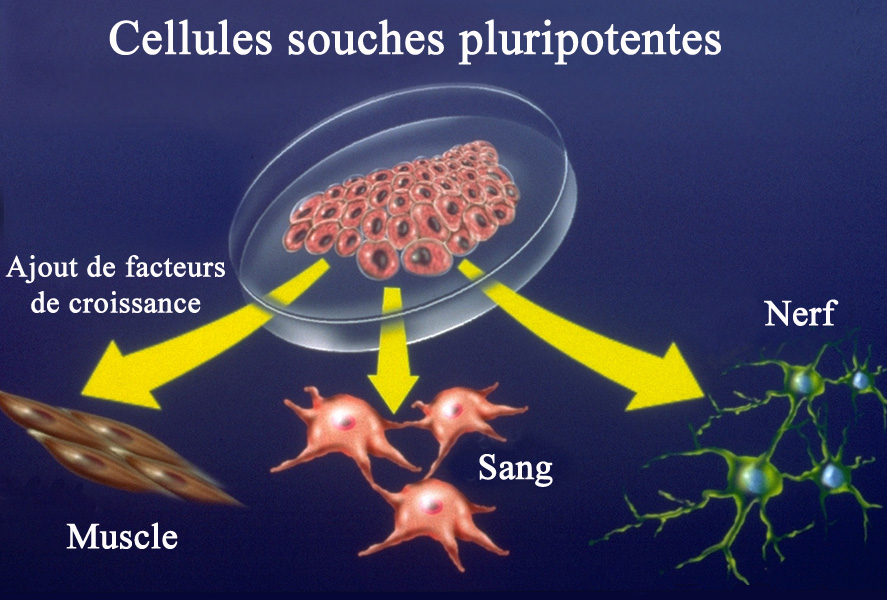
Comment obtenir des cellules souches pluripotentes induites (iPSc) ?
Ces cellules sont obtenues en traitant des cellules déjà différenciées avec des facteurs de transcriptions spécifiques, leur permettant de retrouver leur état pluripotent. Une cellule dites pluripotente a la capacité de se différencier vers tous les types cellulaires de l’organisme (à l’exception des gamètes). Elle pourra par exemple se différencier vers une cellule de foie, de cœur, un globule rouge ou même un neurone.
Si on fait une rapide analogie avec la vie d’un homme par exemple, vous pouvez imaginer un homme d’une soixantaine d’année, boire un mélange lui permettant de redevenir adolescent et de refaire entièrement sa vie.
C’est exactement ce qu’il se passe avec ces cellules !
Comment obtenir des cellules neuronales dopaminergiques à partir de ces IPSc ?
Pour conduire une cellule souche vers le développement d’une population cellulaire désirée, des protocoles de différentiation sont étudiés et testés. L’objectif de ces protocoles est de mimer le développement embryonnaire en exposant les IPSc en culture à des facteurs définis pendant des durées déterminées. En reprenant l’analogie précédemment évoquée, on peut considérer ces protocoles de différenciation comme la formation d’un étudiant, lui permettant de se spécialiser dans un domaine précis.
Tout au long de la différenciation cellulaires, certains marqueurs vont apparaître ou disparaître, attestant de l’orientation des cellules vers un type cellulaire particulier.
Dans certains protocoles, les cellules peuvent être triées en fonction des marqueurs dans le but d’isoler une population particulière. Dans le protocole utilisé par Takahashi, seules les cellules exprimant le marqueur de surface CORIN sont sélectionnés.
En triant les cellules de la sorte on évite d’injecter au patient des cellules qui ne se seraient pas différenciées, c’est-à-dire une cellule restée au stade pluripotent ou ayant empruntée une voie de différenciation différente. L’injection de cellules non différenciées représente le risque majeur de la thérapie cellulaire. Ces cellules pluripotentes présentent une prolifération rapide et sont potentiellement tératogènes. Il est donc capital d’assurer une bonne spécificité des cellules greffées pour éviter l’injection d’une population cellulaire non désirée.

Une étude pré-clinique menée en 2017
Une première étude, menée en 2017 sur 11 singes a été réalisée par l’équipe de Takahashi. L’efficacité de la transplantation sur les symptômes liés à la maladie de Parkinson a été évaluée à travers un score spécifique mesurant les éléments suivants :
– Expression du visage
– Balancement de la tête
– Mouvement spontané
– Mouvement en réponse à un stimulus
– Tremblements
– Instabilité posturale
– Démarche
12 mois après la transplantation, les singes montrent une diminution significative de ce score, se traduisant par une amélioration de l’état général. Une augmentation des mouvements sur cette même période a été observée chez les singes ayant reçu la greffe.
A travers cette étude sur l’Homme, l’équipe de Takahashi vise à reproduire les résultats précédemment obtenus sur les modèles animaux et confirmer la possibilité de mettre en place cette nouvelle prise en charge thérapeutique. ( actuellement en cours )
Article publié sur: www.walkbyresilient.com