
Parkinson: la deuxième maladie neurodégénérative la plus fréquente en France
La maladie de Parkinson est une maladie neurodégénérative caractérisée par la destruction d’une population spécifique de neurones, les neurones à dopamine de la substance noire du cerveau.Les traitements actuels permettent de contrôler les symptômes moteurs associés à la maladie, mais ils sont sans effet sur les autres symptômes et sur la progression de la dégénérescence.Les chercheurs développent des stratégies neuroprotectrices visant à enrayer cette progression. Ils cherchent aussi comment repérer les patients à risque, pour leur administrer au plus tôt ce type de traitement.
Comprendre la maladie de Parkinson
La maladie de Parkinson est la deuxième maladie neurodégénérative la plus fréquente en France, après la maladie d’Alzheimer. Elle constitue en outre une cause majeure de handicap chez le sujet âgé.
Rarissime avant 45 ans, la maladie de Parkinson touche des sujets plus âgés, avec un pic autour de 70 ans : 1 % des plus de 65 ans sont concernés. Au total, entre 100 000 et 120 000 personnes sont touchées en France, et environ 8 000 nouveaux cas se déclarent chaque année. Et compte tenu du vieillissement de la population, l’incidence de la maladie progresse.
Dégénérescence des neurones à dopamine
La maladie de Parkinson se manifeste spécifiquement par la dégénérescence progressive des neurones à dopamine dans la substance noire du cerveau. La disparition de ces cellules s’accompagne de perturbations des réseaux de neurones qui leurs sont associés dans différentes zones du cerveau : au niveau du striatum, du thalamus, du noyau sous thalamique…
La dégénérescence des neurones à dopamine est en outre associée à la présence de corps de Lewy, dans la substance noire et dans d’autres zones du cerveau.Ils correspondent à des amas pathogènes formés par une protéine : l’α-synucléine. Naturellement présente chez les sujets sains, cette protéine est retrouvée au sein des amas pathogènes sous une forme « malade », présentant un problème de conformation qui favoriserait son agrégation anormale. Il a récemment été montré, chez l’animal, que l’α-synucléine « malade » porte l’information nécessaire et suffisante à déclencher la maladie
Une maladie sporadique
Les causes exactes de la dégénérescence neuronale sont incertaines, mais l’âge reste le principal facteur de risque. La dégénérescence des neurones dopaminergiquesserait favorisée par des facteurs génétiques et environnementaux et les mécanismes précipitant cette dégénérescence sont vraisemblablement multiples. Il pourrait s’agir de l’accumulation de radicaux libres, d’un déficit énergétique ou métabolique, ou encore d’un processus inflammatoire. Ces différentes pistes sont à l’étude.
Il existe une susceptibilité génétique à la maladie de Parkinson, mais elle est relativement faible. A ce jour, 21 variants génétiques associés à la maladie ont été identifiés en étudiant le génome de grandes cohortes de patients. L’Inserm a participé à ces travaux dans le cadre du consortium international GEOPD (pour Genetic Epidemiology Of Parkinson’s Disease) ou IPDGC (pour International Parkinson’s Disease Genomics Consortium). Cependant, aucun de ces variants n’a d’effet suffisamment fort pour être prédictif de la maladie à un niveau individuel : un sujet qui présente le profil génétique le plus défavorable voit son risque de développer la maladie multiplié par un facteur seulement égal à 2,5.
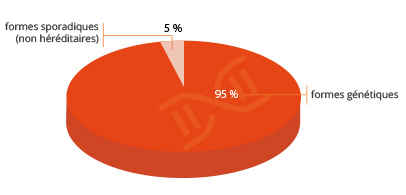
La maladie de Parkinson n’est donc généralement pas une maladie héréditaire. Cependant, il existe environ 5% de formes génétiques, liées à des mutations affectant des gènes spécifiques. Certains ont été identifiés, comme le gène de l’ α-synucléine, le gène LRRK-2 (leucine-rich repeat kinase 2) ou encore le gène de la glucocerebrosidase (GBA). Toutefois, ces mutations ne sont pas systématiquement associées au développement de la maladie. Des études en cours essayent d’identifier les facteurs qui « protègent » les sujets porteurs d’une de ces mutations qui ne développent pas la maladie.
Du côté des facteurs de risque environnementaux, le rôle de l’exposition aux pesticides est bien établi. Des études de cohorte ont notamment été conduites par des chercheurs de l’Inserm, en collaboration avec la Mutualité sociale agricole. Elles ont montré l’existence d’un risque accru de maladie de Parkinson chez les agriculteurs exposés aux insecticides de type organochlorés. La maladie de Parkinson fait d’ailleurs partie du tableau des maladies professionnelles du régime agricole.
Il existe aussi des facteurs environnementaux qui semblent protecteurs. C’est le cas du tabac ou encore du café, peut être en raison de leur effet stimulant sur les neurones à dopamine.
L’interaction entre les facteurs environnementaux et les facteurs génétiques est aujourd’hui un grand champ d’investigation.
Une maladie chronique lentement évolutive
La maladie de Parkinson est une maladie chronique, d’évolution lente et progressive, dont le début est insidieux. La phase préclinique de la maladie, avant l’apparition des premiers symptômes, dure probablement plusieurs années. Pendant cette période, le cerveau compense la baisse de dopamine par des processus de plasticité, permettant un fonctionnement cérébral normal. Les patients restent asymptomatiques jusqu’à ce que 50 à 70% des neurones à dopamine soient détruits et que le cerveau ne soit plus en mesure de compenser.
Une triade de symptômes moteurs
Le diagnostic de la maladie de Parkinson repose sur l’existence de trois principaux symptômes moteurs. Ils ne sont pas forcément tous présents en même temps et peuvent être d’intensité variable. Ils restent longtemps asymétriques, ne touchant qu’un côté du corps. Il s’agit de :
- L’akinésie, une lenteur dans la mise en œuvre et la coordination des mouvements. Elle interfère avec toutes les activités de la vie courante, y compris la marche.
- L’hypertonie, une rigidité excessive des muscles. Elle peut toucher tous les muscles du corps, y compris le rachis. Elle provoque notamment une posture penchée vers l’avant.
- Les tremblements, survenant au repos, affectant surtout les mains et les bras. Ils peuvent être intermittents et ne sont pas systématiques, épargnant environ 30% des patients.
Des symptômes non moteurs
La maladie de Parkinson se manifeste également par des symptômes non moteurs, résultant probablement des répercussions de la maladie sur des structures cérébrales non dopaminergiques :
- problèmes de sommeil
- perte d’odorat (anosmie)
- troubles cognitifs
- troubles de l’équilibre
- douleurs
- constipation
- mictions urgentes
- dépression…
Il est possible que certains de ces symptômes apparaissent avant les symptômes moteurs et soient annonciateurs de ces derniers. C’est notamment le cas des troubles du comportement en sommeil paradoxal (mouvements brusques voire violents accompagnant les rêves) : des études suggèrent que les personnes touchées par ces troubles présentent un risque accru de développer la maladie de Parkinson.
Plusieurs stades d’évolution
Il existe plusieurs stades de la maladie de Parkinson, reflétant l’évolution de sa sévérité :
- Stade I : premiers signes unilatéraux, ne gênant pas la vie quotidienne.
- Stade II : signes encore unilatéraux, mais entraînant une gêne.
- Stade III : signes bilatéraux, posture modifiée, pas de handicap grave, autonomie complète.
- Stade IV : handicap plus sévère, marche encore possible, autonomie limitée.
- Stade V : marche impossible (fauteuil roulant, alitement), perte d’autonomie.
Traiter les symptômes moteurs
La prise en charge de la maladie de Parkinson consiste à compenser le déficit en dopamine par :
- un apport exogène en précurseurs de la dopamine (L-dopa), ou grâce à des molécules qui miment son effet au niveau des neurones (agonistes de la dopamine).
- en inhibant les enzymes qui dégradent la dopamine du cerveau (inhibiteurs de la monoamine oxydase de type B, inhibiteurs de la C-O-méthytransférase qui potentialisent les effets de la L-dopa).
L’efficacité de ces traitements sur les symptômes moteurs est bonne, tout au long de la maladie. Néanmoins, ces médicaments n’empêchent pas la progression de la dégénérescence neuronale : pour préserver l’efficacité du traitement, les doses doivent donc être adaptées au cours de l’évolution de la maladie.
Par ailleurs, ces traitements ne sont pas efficaces sur les symptômes non moteursqui résultent souvent de perturbations autres que dopaminergiques. La recherche de nouveaux traitements ciblant les symptômes qui ne sont pas sensibles aux médicaments dopaminergiques est donc un défi pour les années futures
Des complications motrices après 5 à 10 ans de traitement
Généralement après cinq à dix ans de traitement, des complications contre lesquelles il est difficile de lutter surviennent. Les patients connaissent des « phases on-off » au cours desquelles l’efficacité du traitement dopaminergique varie selon les moments de la journée : des périodes de mobilité sont entrecoupées de phases d’akinésie (blocage des mouvements, avec des difficultés à la marche et des risques de chute).
Ces patients doivent également faire face à des dyskinésies, c’est à dire à des mouvements anormaux et involontaires. Ces effets indésirables, en rapport avec l’administration intermittente de L-dopa et des pics de concentration dans le cerveau, peuvent être très invalidants.
La stimulation cérébrale profonde
C’est précisément à ce stade de la maladie, chez des patients concernés par des fluctuations motrices et des dyskinésies, que la stimulation cérébrale profonde a fait les preuves de son effet bénéfique. La technique consiste à implanter des électrodes dans le noyau subthalamique, afin d’émettre des impulsions électriques grâce à un boitier implanté sous la peau.Cette approche thérapeutique concerne entre 400 et 500 personnes par an en France. Compte tenu de son caractère invasif, elle est réservée aux patients présentant un handicap important lié aux fluctuations motrices ou aux dyskinésies, et capables de supporter l’intervention (moins de 70 ans).
L’administration d’apomorphine par une pompe sous-cutanée ou de L-dopa en continue par sonde gastrique sont des alternatives intéressantes permettant une stimulation continue par la dopamine. Elles peuvent notamment être proposées aux patients qui ne peuvent bénéficier de la stimulation cérébrale profonde.
Des mesures non médicamenteuses à ne pas négliger
- La kinésithérapie entretient les muscles et les articulations. Elle améliore la marche et l’équilibre.
- La rééducation orthophonique est parfois nécessaire pour prévenir ou corriger les troubles de la déglutition, les difficultés à parler ou encore la gêne à l’écriture.
Les enjeux de la recherche
Le ministère de la Santé a récemment créé des centres experts sur la maladie de Parkinson au sein des CHU français. L’objectif est d’améliorer la prise en charge de la maladie et de développer la recherche : un réseau de recherche est en effet adossé à ces 24 centres experts, dont 16 sont des centres labélisés pour la recherche clinique (Centre d’investigation clinique – CIC).
Les aspects fondamentaux
La découverte des causes et des mécanismes des dégénérescences neuronales et de l’apparition des symptômes est un objet de recherche important.
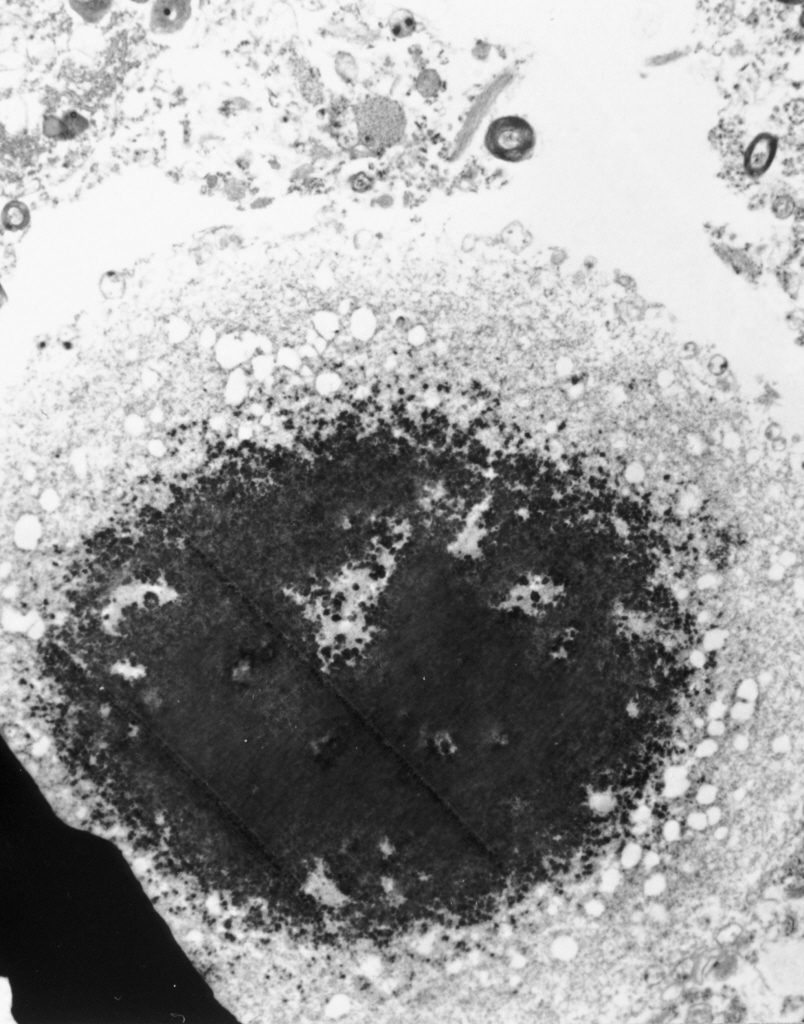
Ainsi, à Bordeaux, une équipe de l’Institut des maladies neurodégénératives tente de comprendre pourquoi et comment les protéines d’α-synucléine s’agglomèrent pour former les corps de Lewy et se propagent de neurone en neurone. Cette recherche pourrait aboutir à l’utilisation d’anticorps dirigés contre l’α-synucléine, pour la neutraliser et éviter sa propagation dans le cerveau des patients.
D’autres équipes étudient le rôle des mitochondries dans la dégénérescence neuronale. Les mitochondries sont les « centrales énergétiques » de la cellule. Plusieurs études font état d’une altération précoce du réseau mitochondrial au cours du processus neurodégénératif. Des travaux récents montrent que certains gènes impliqués dans des formes familiales de la maladie de Parkinson joueraient un rôle essentiel dans l’élimination des mitochondries malades, évitant ainsi leur accumulation dans le neurone. Des chercheurs Inserm du Centre de physiopathologie de Toulouse-Purpan et de l’Institut du cerveau et de la moelle épinière (Paris) ont montré que l’injection d’une protéine virale qui améliore la qualité du réseau mitochondrial (protéine X), réduit de moitié les dégénérescences neuronales chez des souris parkinsoniennes.
Autre piste de travail, notamment pour une équipe de l’Ecole normale supérieure de Lyon, le réticulum endoplasmique. Ce compartiment cellulaire héberge des protéines (les « chaperones ») qui permettent aux protéines nouvellement produites d’acquérir leur bonne conformation. Or, dans un contexte de maladie de Parkinson, l’accumulation d’α-synucléine dans ce compartiment perturbe la fonction des chaperonnes. Il en résulte de nombreuses protéines mal conformées, qui génèrent un stress important et durable du réticulum endoplasmique. Ce stress provoque l’émission de signaux de mort cellulaire. Cependant, si ce stress est transitoire et léger, il semble rendre plus résistant à la maladie de Parkinson, tout au moins dans des modèles d’études précliniques. Cet effet inattendu et remarquable ouvre de nouvelles perspectives thérapeutiques.
L’inflammation cérébrale générée par la mort neuronale est encore une autre piste étudiée : les neurones malades, ou en voie de dégénérescence, émettent en effet différents signaux qui provoquent l’activation de cellules environnantes, et en particulier celle des cellules microgliales. Ces cellules sont responsables d’un processus inflammatoire local qui provoque lui-même l’arrivée d’autres cellules impliquées dans l’inflammation et défavorables à la survie des neurones résiduels : un véritable cercle vicieux se met en place.
Ces différents dysfonctionnements coexistent probablement. Les futurs traitements associeront donc certainement différentes molécules ciblant plusieurs d’entre eux.
Améliorer les traitements
Des chercheurs tentent d’améliorer l’efficacité des traitements, non seulement pour réduire les symptômes de la maladie, mais surtout pour ralentir sa progression et limiter l’apparition de complications de type « on-off » et dyskinésies. Plusieurs stratégies sont en cours de développement : nouveaux médicaments, amélioration de la chirurgie, thérapie cellulaire, thérapie génique…
Le développement de nouveaux médicaments ciblant les symptômes moteurs et non moteurs est en cours. Les pistes thérapeutiques actuelles reposent sur la modulation des systèmes contrôlant le mouvement indépendamment de la dopamine (systèmes glutamatergiques, adénosinergiques ou sérotoninergiques). Le réseau de recherche clinique pour la maladie de Parkinson (NS-Park) a été récemment labellisé pour promouvoir ces études en France et mettre en œuvre des études à dimension Européenne.
Améliorer la stimulation cérébrale profonde est un second objectif. Les chercheurs tentent d’identifier les zones du cerveau les plus pertinentes à cibler pour lutter contre l’ensemble des symptômes associés à la maladie de Parkinson. Cette technique est actuellement réservée aux patients dont la maladie est « ancienne », avec plus de dix ans d’évolution, mais de récents travaux suggèrent qu’elle pourrait être bénéfique plus précocement, après seulement quelques années d’évolution. Cela soulève la question de savoir qui il faut opérer en priorité : les patients les plus sévèrement atteints ou ceux qui sont à risque d’évolution sévère ? Une étude devrait en outre bientôt débuter pour tester l’intérêt de cette approche chez les patients âgés de plus de 70 ans.
La thérapie cellulaire est une autre approche thérapeutique en développement. Elle consiste à injecter des neurones fonctionnels pour remplacer les neurones dégénérés. Depuis les années 2000, il est en effet possible d’obtenir des neurones à dopamines différenciés et fonctionnels à partir de cellules souches embryonnaires. Des essais ont eu lieu chez l’homme, mais les bénéfices cliniques sont mitigés : rien ne permet de trancher sur l’efficacité de cette technique complexe par rapport aux médicaments ou à la stimulation cérébrale profonde. La recherche se poursuit néanmoins. L’idée est maintenant de procéder à une greffe à partir de cellules souches issues du patient lui-même, pour éviter les incompatibilités entre donneurs et receveurs, et donc le risque de rejet de greffe.
L’utilisation de la thérapie génique est également étudiée. L’idée est de soigner grâce à des gènes qui s’exprimeraient dans le cerveau, afin d’y produire de la dopamine en continu. Les résultats d’un essai de phase I coordonné à l’hôpital Henri-Mondor (Créteil) sont encourageants. Les chercheurs ont introduit trois gènes codants pour des enzymes nécessaires à la synthèse de dopamine dans un vecteur viral. Ils ont ensuite injecté ce vecteur dans le striatum de quinze patients présentant des complications motrices. Une production de dopamine et une amélioration de certains symptômes moteurs ont été obtenues. Un essai clinique de phase II devra quantifier l’efficacité de cette thérapie à court, mais aussi à long terme : en effet, cette technique n’empêche pas la dégénérescence des neurones.
Ralentir la dégénérescence
Les chercheurs tentent par ailleurs de développer des thérapeutiques permettant de ralentir ou même de stopper la progression de la dégénérescence : cela marquerait une avancée considérable dans la lutte contre la maladie de Parkinson.
Ils s’intéressent dans ce but, à des médicaments neuroprotecteurs. Ainsi, un essai thérapeutique conduit au CIC de Toulouse a montré qu’un inhibiteur de la monoamine oxydase, la rasagiline, pourrait ralentir la progression de la maladie. Cet effet est cependant modeste. L’utilisation d’autres molécules neuroprotectrices est actuellement à l’étude.
Une autre piste pourrait s’avérer intéressante : celle des facteurs neurotrophiques. Il s’agit de protéines secrétées dans le cerveau qui contribuent au développement et au fonctionnement des cellules nerveuses. L’idée serait de les utiliser pour préserver les neurones dopaminergiques et favoriser leur croissance. Ces protéines ne sont pas directement injectables dans le cerveau et doivent donc être « administrées » par thérapie génique. Des essais cliniques ont déjà été conduits. Ils s’avèrent concluants en termes d’expression des protéines thérapeutiques dans le cerveau, mais aucune amélioration des symptômes n’a été constatée. Des progrès restent donc à faire dans ce domaine.
L’utilisation de chélateurs de fer constitue une autre approche en cours de développement. Un chélateur de fer est une molécule capable de se fixer au fer pour former un complexe qui sera éliminé dans les urines. Or la substance noire des patients parkinsoniens présente une forte concentration en fer, associée à la formation de radicaux libres délétères pour les neurones. Les résultats des premiers essais sont encourageants. Ils doivent être confirmés dans le cadre d’un essai qui sera réalisé à l’échelle européenne, piloté par le CHU de Lille, l’Inserm et le réseau NS-Park.
Dépister le plus tôt possible
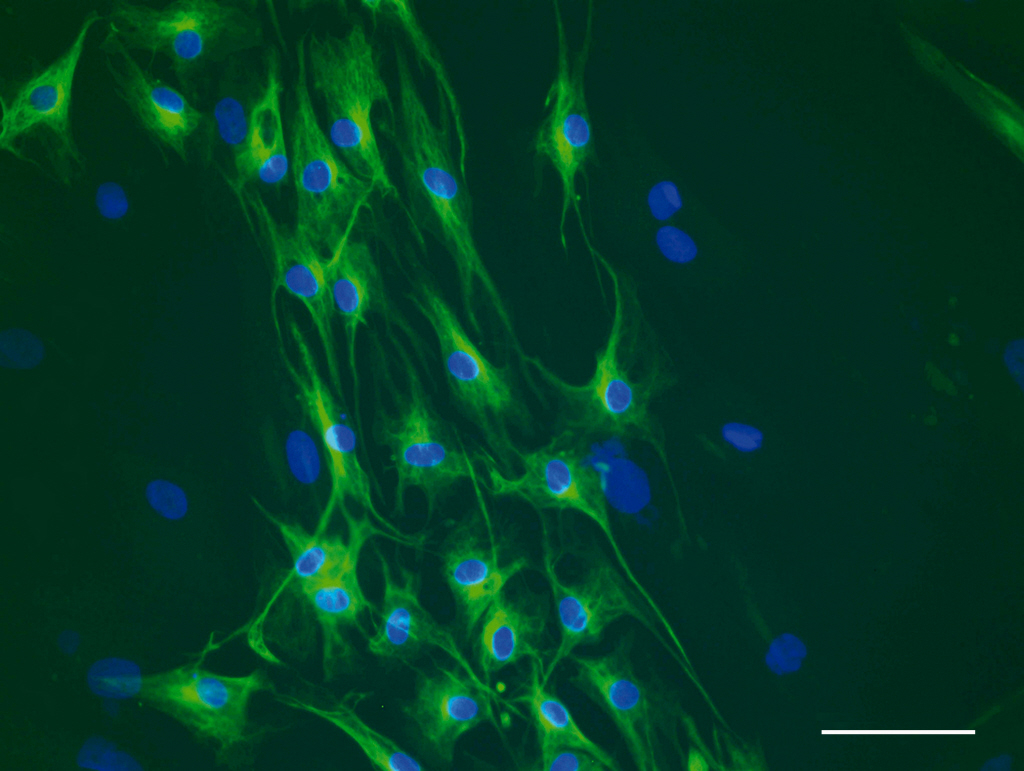
La recherche sur les médicaments neuroprotecteurs s’accompagne du besoin de dépister les patients le plus précocement possible : l’objectif, à terme, est de pouvoir administrer le traitement dès le début de la dégénérescence, si possible avant même l’apparition des symptômes. C’est pourquoi un effort considérable de recherche se focalise sur l’identification de marqueurs radiographiques ou biologiques de la neurodégénérescence. Actuellement, aucun test sanguin ou méthode d’imagerie ne permet de suivre l’évolution de la maladie de Parkinson.
Les chercheurs tentent de mettre en évidence des marqueurs en étudiant des cohortes de patients à risque de développer la maladie (sujets porteurs de mutations génétiques ou ayant des symptômes « précurseurs » de la maladie). Ces études s’étaleront sur plusieurs années. Elles comportent des examens cliniques, des explorations du sommeil, des IRM cérébrales, des échographies de la substance noire (pour visualiser les dépôts de fer), des examens par imagerie nucléaire (PET)… Plusieurs cohortes sont actuellement suivies en France et dans le cadre de collaborations internationales afin d’augmenter les chances de trouver ces marqueurs.
Article édité par: www.inserm.fr




